Свинец
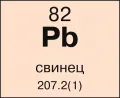
Области знаний: Общие вопросы химии Символ: Pb Атомный номер: 82 Группа элементов: Постпереходные металлы Относительная атомная масса: 207,2 а. е. м. Радиус атома: 175 пм Электроотрицательность: 2,33 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность: 11,3415 г/см³ при 20 °C Температура плавления: 327 °C Температура кипения: 1751 °C
Химические элементы Химические элементы
Свинец
Свине́ц (лат. Plumbum), Pb, химический элемент IV группы короткой формы (14-й группы длинной формы) периодической системы ; атомный номер 82, атомная масса 207,2 а. е. м. Природный свинец – смесь стабильных изотопов 204 Рb (1,4 %), 206 Рb (23,6 %), 207 Рb (22,6 %) и 208 Рb (52,4 %); 206 Рb, 207 Рb и 208 Рb – члены природных радиоактивных рядов соответственно 238 U, 235 U и 232 Th; природные радиоизотопы 210 Рb (наиболее долгоживущий, период полураспада T1/2 22,3 года), 211 Рb, 212 Рb и 214 Рb. Наиболее долгоживущий искусственный радиоизотоп 205 Pb (T1/2 около 15,3 млн лет).
Историческая справка
Свинец выплавляли из руды в Месопотамии, Малой Азии, Египте, Греции и Риме 8 тыс. лет назад; вероятно, это первый известный человеку металлургический процесс. Свинец применяли для покрытия керамики глазурью , изготовления монет и статуй (Древний Египет), листовой свинец служил настилом для сохранения влаги (Вавилон), материалом труб водопровода , обшивки деревянных корпусов кораблей (Древний Рим), кровли зданий (Британия) и др. Использовали свинец для очистки золота и серебра методом купелирования . Геродот в 5 в. до н. э. писал о методе укрепления железных и бронзовых скоб в каменных плитах путём заливки отверстий свинцом. Такие скобы были найдены при раскопках Микен. С изобретением огнестрельного оружия свинец стал материалом для изготовления пуль и дроби. Вплоть до 17 в. свинец путали с оловом (лат. plumbum album – «белый свинец», т. е. олово; лат. plumbum nigrum – «чёрный свинец», собственно свинец). Происхождение названия «свинец» неясно.
Распространённость в природе
Содержание свинца в земной коре 1,3·10 −3 % по массе, в водах океана 0,03 мкг/дм 3 , в речных водах 0,2–8,7 мкг/дм 3 . Природный фон в атмосфере 2·10 −9 –5·10 −4 мкг/м 3 . В теле взрослого человека содержится 7–15 мг Pb. Известно около 80 минералов, содержащих Pb; промышленное значение имеют галенит PbS, англезит PbSO4, церуссит РbСО3, пироморфит Pb5(PO4)3Cl. В месте залегания свинцовых руд почва, растения и воды содержат до 1 % Pb.
Свойства
Конфигурация внешних электронных оболочек атома свинца 6s 2 6p 2 ; степени окисления +2 (наиболее характерная) и +4; энергии последовательной ионизации соответственно равны 715, 1450, 3081 и 4082 кДж/моль; электроотрицательность по Полингу 2,33; атомный радиус 175 пм, ковалентный радиус 146 пм, ионные радиусы (в скобках даны координационные числа ) Рb IV 79 пм (4), 92 пм (6), Рb II 112 пм (4), 133 пм (6).

Образец свинца. Образец свинца. Свинец – металл синевато-серого цвета, легкоплавкий, tпл 327 °C, tкип 1751 °C; плотность 11 341,5 кг/м 3 (20 °C); кристаллизуется в гранецентрированной кубической решётке . Свинец хороший поглотитель рентгеновского и γ-излучения ; поперечное сечение захвата тепловых нейтронов около 0,2·10 −28 м 2 . Слабо тепло- и электропроводен; диамагнетик ; температура перехода в сверхпроводящее состояние 7,2 К. Свинец мягок, пластичен, легко прокатывается в тончайшие листы. Твёрдость по Бринеллю 25–40 МПа; относительное удлинение при разрыве 50–70 %. Свинец практически не растворяет газообразные N2, CO, CO2, O2, SO2, H2.
Свинец – химически инертен. В сухом воздухе не окисляется, во влажном – тускнеет, покрываясь плёнкой оксидов, переходящих в присутствии СО2 в осно́вную соль состава Рb2(CO3)(ОН)2. С кислородом образует оксиды Рb2О, РbО, РbО2, Рb3О4, Рb2О3. При комнатной температуре не реагирует с разбавленными H2SO4 и НСl, т. к. на поверхности образуются труднорастворимые PbSO4 и РbСl2. С разбавленными азотной и уксусной кислотами образует хорошо растворимые Pb(NO3)2 и Рb(СН3СОО)2, с концентрированной серной и соляной кислотами при нагревании – растворимые Pb(HSO4)2 и Н2[РbСl4]. Взаимодействует с HF и щелочами в водном растворе только при нагревании, реагирует с лимонной , муравьиной и винной кислотами. Растворимые соли Pb(II) подвержены гидролизу , который при кипячении растворов приводит к осаждению осно́вных солей.
Производные Pb(IV) можно получить электролизом подкислённых растворов солей Pb(II). Наиболее известные среди них сульфат свинца(IV) Pb(SO4)2 и ацетат свинца(IV) Рb(ОСОСН3)4. Производные Pb(IV), как правило, подвергаются необратимому гидролизу; в случае PbCl4 под действием воды происходит образование PbCl2 и выделение Cl2 ( окислительно-восстановительная реакция ). При разрядке свинцового аккумулятора Pb(IV) служит окислителем ( Р b + Р b O 2 + 2 H 2 S O 4 = 2 P b S O 4 + 2 Н 2 О Рb+РbO_2+2H_2SO_4 =2PbSO_4+2Н_2О Р b + Р b O 2 + 2 H 2 S O 4 = 2 P b S O 4 + 2 Н 2 О ). С расплавами щелочей оксиды Pb(IV) и Pb(II) дают двойные оксиды, например (Na2Pb)O3, (Na2Pb)O2; в концентрированных растворах щелочей при нагревании образуются гидроксокомплексы типа Na2[Рb(ОН)6].
При нагревании свинец реагирует с галогенами , образуя производные Pb(II) и Pb(IV): РbI2, РbВr2, PbCl2, РbВr4, PbCl4, PbF4; с серой при нагревании свинец даёт PbS. Гидриды для свинца не характерны. Важное органическое производное свинца – тетраэтилсвинец Pb(C2H5)4.
Получение
Основной источник Pb – сульфидные полиметаллические руды . Обогащая руды (1–5 % Рb) методом флотации , получают свинцовые концентраты (содержащие 40–75 % Рb, 5–10 % Zn, до 5 % Сu, благородные металлы и Bi). Технология получения свинца включает агломерирующий обжиг сульфидных концентратов, шахтную восстановительную плавку агломерата и рафинирование чернового свинца. При обжиге PbS окисляется кислородом воздуха, продуваемого в расплав , содержащий добавки флюсов (SiO2, CaCO3, Fe2O3): 2 P b S + 3 О 2 = 2 Р b О + 2 S O 2 2PbS+3О_2=2РbО+2SO_2 2 P b S + 3 О 2 = 2 Р b О + 2 S O 2 . В готовом агломерате содержится 35–45 % Рb и 1,2–3 % S (в том числе в виде сульфатов ). Агломерат смешивают с коксом и направляют на восстановительную плавку в шахтные печи , в которые подаётся воздух или воздушно-кислородная смесь. В печи протекает двухстадийная экзотермическая реакция ( 2 P b S + 3 O 2 = 2 P b O + 2 S O 2 2PbS+3O_2=2PbO+2SO_2 2 P b S + 3 O 2 = 2 P b O + 2 S O 2 и P b S + 2 Р b О = 3 Р b + S O 2 PbS+2РbО=3Рb+SO_2 P b S + 2 Р b О = 3 Р b + S O 2 ), продукт которой – черновой свинец (извлечение Рb достигает 90–94 %). Отходы процесса плавки ( шлаки ) направляются на дальнейшую переработку для извлечения Zn. Образующаяся при шахтной плавке (и агломерации) пыль служит исходным сырьём для извлечения редких и рассеянных элементов. Черновой свинец содержит 93–98 % Рb и примеси: Сu (1–5 %), Sb, As, Sn (0,5–3 %), Bi (0,05–0,4 %) и др. Очистку чернового свинца производят пирометаллургическим или электролитическим способом. Объём мирового производства свинца около 10,18 млн т/год (2018).
Применение
До 45 % от общего потребления свинца идёт на производство электродов аккумуляторов ; до 20 % – на изготовление проводов, кабелей и покрытий к ним. Свинец используют для изготовления футеровки , труб и аппаратуры в химической промышленности. Применяют сплавы свинца с Sn, Са, Sb, Cu, As, Cd. В строительстве свинец используют в качестве изоляции, уплотнителя швов, стыков, при создании сейсмостойких фундаментов, в военной технике – для изготовления шрапнели и сердечников пуль. Экраны из свинца служат для защиты от радиоактивного и рентгеновского излучений. Соединения свинца входят в состав пигментов , эмалей , стёкол , керамики , материалов оптоэлектроники и т. д.
Свинец токсичен . Основные источники загрязнения свинцом окружающей среды: металлургические предприятия, выхлопные газы двигателей внутреннего сгорания , сточные воды промышленных предприятий и др.
Аликберова Людмила Юрьевна . Первая публикация: Большая российская энциклопедия, 2015.
Опубликовано 2 мая 2023 г. в 10:53 (GMT+3). Последнее обновление 2 мая 2023 г. в 10:53 (GMT+3). Обратная связь
Свинец
Свинец был известен жителям Месопотамии и Древнего Египта за 7 тысяч лет до нашей эры, свинец и его соединения использовались в Древней Греции и Древнем Риме. Из свинцовых руд на острове Родос три тысячи лет тому назад получали Происхождение названия [ ]
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербс
ко-хорватском , чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы : svinas (литовский), svin (латышский).
Английское название свинца lead и русским «лудить», хотя лудят опять же не ядовитым свинцом, а оловом. Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Нахождение в природе [ ]
Получение [ ]
Основной источник получения свинца — сульфидные галенит PbS. На первом этапе руду обогащают. Полученный концентрат подвергают окислительному обжигу:
При обжиге добавляют кислородом (автогенный способ). Процесс протекает в два этапа:
PbS + 2PbO = 3Pb + SO2↑.
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс.тонн:
| ЕС | 2038 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства [ ]
Свинец — металл голубовато-серого цвета с кубической гранецентрированной решеткой, а = 0,49389 нм. Плотность 11,3415 кг/дм 3 , температура плавления 327,4—327,50 °C кипения 1715—1745 °C.
Некоторые другие свойства приведены в таблице (см. выше).
Химические свойства [ ]
Химически свинец довольно инертен. Во влажном воздухе поверхность свинца тускнеет, покрываясь сначала оксидной пленкой, которая постепенно переходит в основной карбонат:
-
PbO (формы: кислотами: PbО + серной и соляной кислотами, так как на его поверхности при этом образуются плохо растворимые сульфат свинца PbSO4 и хлорид свинца PbCl2. Но с органическими кислотами ( азотной свинец реагирует, образуя соли свинца (II): 3Pb + 8HNO3 = 3Pb (NO3)2 + 2NO↑ + 4H2O. При взаимодействии свинца с уксусной кислотой, с продувкой кислорода, образуется ацетат свинца Pb(CH3COO)2, т. н. « Применение [ ]
До 45 % свинца идет на изготовление пластин свинцово-кислотных аккумуляторов . 20 % — на изготовление проводов, кабелей и покрытий к ним. Экраны из свинца служат для защиты от рентгеновского излучения. Из свинца и его сплавов изготавливают радиоактивных веществ. Небольшие количества свинца постоянно расходуются для производства азида свинца в качестве детонатора (первичного взрывчатого вещества). Сплавы свинца с Sb, Sn и Cu используют для изготовления типографских шрифтов, из сплавов свинца с Sb и As изготавливают сердечники пуль, хрусталя, для строительства сейсмостойких фундаментов. Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Теллурид свинца широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К). Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6) используемой во флотационном обогащении руд, так же он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока . Висмутат свинца,сульфид свинца,йодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях.Хлорид свинца в качестве катодного материала в резервных источниках тока. Теллурид свинца самый широкоприменяемый материал в производстве свинцово-хлорный элемент , свинцово-плавиковый элемент и др.
Экономические показатели [ ]
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг. Страны, крупнейшие потребители свинца в 2004 году, в тыс.тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие [ ]
Свинец и его соединения — токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м 3 , в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
Ссылки [ ]
- Свинец на Webelements
- Свинец в Популярной библиотеке химических элементов
- Химия на сайте РХТУ
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Выделить Свинец и найти в:
- Вокруг светаадрес
- Академикадрес
- Астронетадрес
- Элементыадрес
- Научная Россияадрес
- Кругосветадрес
- Научная Сеть
- Традиция — адрес
- Циклопедия — адрес
- Викизнание — адрес
- Bing
- Yahoo
- Яндекс
- Mail.ru
- Рамблер
- Нигма.РФ
- Спутник
- Google Scholar
- Апорт
- Онлайн-переводчик
- Архив Интернета
- Научно-популярные фильмы на Яндексе
- Документальные фильмы
- Список ru-вики
- Вики-сайты на русском языке
- Список крупных русскоязычных википроектов
- Каталог wiki-сайтов
- Русскоязычные wiki-проекты
- Викизнание:Каталог wiki-сайтов
- Научно-популярные сайты в Интернете
- Лучшие научные сайты на нашем портале
- Лучшие научно-популярные сайты
- Каталог научно-познавательных сайтов
- НАУКА В РУНЕТЕ: каталог научных и научно-популярных сайтов
- Страница 0 — краткая статья
- Страница 1 — энциклопедическая статья
- Разное — на страницах : 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в « Свинец 1 », чтобы сохранить ее
Комментарии читателей: [ ]
Источник https://bigenc.ru/c/svinets-765310
Источник https://science.fandom.com/ru/wiki/%D0%A1%D0%B2%D0%B8%D0%BD%D0%B5%D1%86
